近日,百度开云体育app脑科学与类脑研究院和北京大学第六医院合作在Nature子刊Signal Transduction and Targeted Therapy杂志(STTT,Q1区,IF=38.1)《Non-coding RNAs expression in SARS-CoV-2 infection: pathogenesis, clinical significance and therapeutic targets》,探讨了宿主来源非编码RNA(Non-coding RNAs,ncRNAs)在新型冠状病毒(SARS-CoV-2)感染中的表达变化和调控机制,并总结了有望用于新冠诊疗的潜在标记物和治疗策略,为新冠感染及未来传染病大流行的预防控制提供了新的思路。
人类基因组中约90%以上为ncRNAs,其中微小RNA(MicroRNAs,miRNAs)、长链非编码RNA(Long non-coding RNAs,lncRNAs)、以及环形RNA(Circle RNAs,circRNAs)的作用机制逐渐明晰(图1),并在多种生理和病理过程中发挥着重要的调控作用,另外它们在疾病的诊断、治疗和预后中展现出一定的临床应用价值。
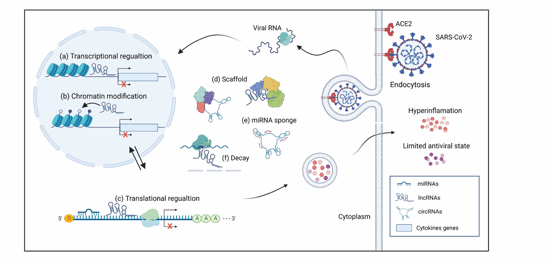
图1 ncRNAs的作用机制
新冠感染后宿主来源ncRNAs的表达变化
目前,高通量测序技术和RT-PCR技术已被广泛应用于临床检测,许多研究通过采集新冠感染患者的血液、唾液、尿液、脑脊液等样本开展全转录组测序,表征宿主来源的miRNAs、lncRNAs和circRNAs感染应答的转录特征,其中miRNAs的研究数量最多。与健康对照相比,新冠感染患者中大量miRNAs、lncRNAs和circRNAs的表达水平发生改变;在不同严重程度的患者组别中,比如无症状、轻度、中度和重度患者,也存在差异表达的miRNAs和lncRNAs;并且,在复阳患者中,lncRNAs和circRNAs的表达水平也与健康对照存在差异。更加特异的是,与流感病毒感染患者相比,在新冠感染患者中发现了差异表达的miRNAs,可能是造成新冠感染不同于其他病毒感染的因素之一。在时间维度上,miRNAs和lncRNAs表现出高敏感性,在病毒感染7天内甚或到康复期,二者的表达谱仍发生动态变化。为什么SARS-CoV-2感染会导致宿主来源ncRNAs表达发生变化?可能的机制是SARS-CoV-2入侵后干扰了ncRNAs合成途径中的关键因子,比如参与mRNA剪接过程的蛋白等,造成整体或部分ncRNAs的表达异常。
宿主来源ncRNAs在新冠病毒致病过程中的作用机制
宿主来源miRNAs、lncRNAs和circRNAs参与调节新冠感染发生发展的多个过程,包括病毒侵入和复制、免疫反应、多器官损伤,甚至长期后遗症(图2)。并且,宿主来源ncRNAs在病毒感染中的调控作用具有双向性,既可以发挥“抗病毒感染”作用,也可以发挥“促病毒感染”作用。
宿主来源ncRNAs参与调节SARS-CoV-2吸附和侵入细胞的过程。SARS-CoV-2侵入靶细胞前,首先需要由宿主细胞中的FURIN蛋白将病毒Spike蛋白分解成S1和S2亚基,部分miRNAs受到病毒侵入影响,通过与FURIN结合,促进病毒的剪切过程。之后,SARS-CoV-2侵入靶细胞时,主要在TMPRSS2介导下与ACE2受体结合内吞至细胞。在该过程中,许多miRNAs和lncRNAs可以通过靶向调控ACE2或TMPRSS2发挥作用。例如,GATA5可以抑制编码ACE2受体的DNA表达,并在新冠感染患者,特别是重症患者中,表达水平显著升高,可能起到抗病毒的作用。
宿主来源ncRNAs参与调节SARS-CoV-2基因组的复制。病毒侵入靶细胞后,部分miRNAs可以与SARS-CoV-2基因组的编码区结合,抑制病毒基因的复制,例如miR497-5p、miR-21-3p和miR-195-5p。另外,部分circRNA/lncRNA、miRNA和mRNA通过形成调控网络,发挥抑制病毒复制的作用。
宿主来源ncRNAs参与调节机体的免疫反应。SARS-CoV-2的大量复制会导致机体先天性免疫和适应性免疫出现异常。其中,宿主来源miRNAs、lncRNAs和circRNAs可以通过调控(1)干扰素和炎症因子信号通路和(2)B细胞和T细胞等免疫细胞的生成和功能来发挥作用。例如,hsa_circ_0000479在新冠感染患者中表达水平升高,通过与miR-149-5p结合促进视黄酸诱导基因蛋白-Ⅰ的生成,提高白细胞介素-6的表达水平。
宿主来源ncRNAs参与调控新冠感染引起的多器官损伤甚至长期后遗症。SARS-CoV-2感染不仅会引起机体的呼吸系统出现异常,还可能损害神经系统、心血管系统、消化系统、生殖系统等多种器官组织,甚至部分症状在患者康复后依然存在,也即“长新冠”。目前,主流观点认为病毒入侵和残留可能是导致多器官损伤和长期后遗症的重要原因。在该过程中,宿主来源ncRNAs主要通过调控炎症因子信号通路和组织发挥功能。例如,MALAT1和SMC2-AS1可以通过Wnt、TGF-β等信号通路调控肺组织的再生和修复;miR-133a参与炎症引起的心肌细胞损伤过程;miR-15a-5p可以通过靶向可溶性程序性细胞死亡蛋白-1调控多种炎症因子的生成,促进抑郁、焦虑和恐惧行为;let-7b-5p可能通过调节肌肉组织功能而参与疲劳等症状的发生。
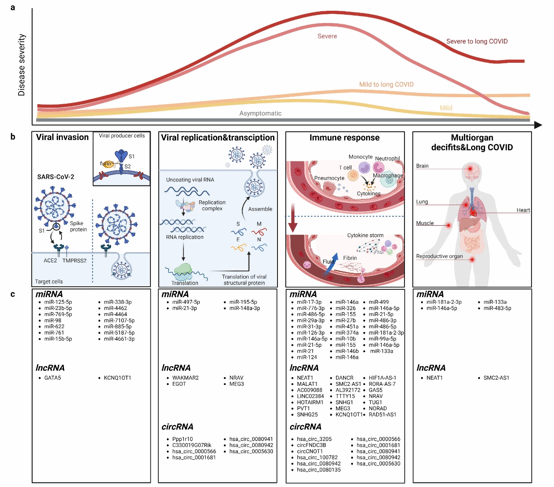
图2 宿主来源ncRNAs在新冠感染发生发展中的功能和代表性ncRNAs
潜在的ncRNAs标记物
新冠感染的严重程度分型主要依赖临床症状,存在一定的滞后性,可能导致延误最佳治疗时机。因此,使用宿主来源ncRNAs作为生物标记物,对长期监控疾病发展和及时确定治疗方案具有重要的临床价值。例如,在新冠感染的疾病分型中,miRNAs和lncRNAs可用于区分轻度/中度和重度患者,而且区分轻症患者和重症患者的效果优于传统指标如白细胞和C反应蛋白等;在新冠感染的结局预测中,由miRNAs组成的预测模型判断患者死亡风险时具有较高的敏感性和特异性,部分miRNAs和lncRNAs可用于预测患者的长期症状;另外,对比药物治疗无效的新冠患者,药物治疗有效的患者中存在特异性表达miRNAs,为新冠感染精准治疗及病情预测提供了潜在标记物。但是,ncRNAs的表达会受到年龄、性别和共病等因素的影响,在实际应用时还需要多方考虑。
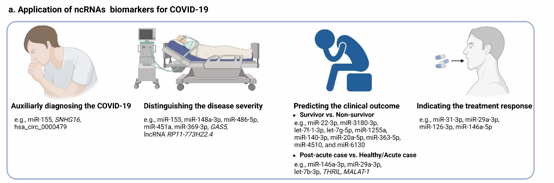
图3 潜在ncRNAs标记物在新冠感染中的应用场景
基于ncRNAs开发新型治疗策略
目前,新冠感染的主要治疗措施可以分为三类:抗病毒药、单克隆抗体和血浆治疗。但是,这类小分子抑制剂和疫苗无法直接作用于患者的基因组,存在一定的局限性。随着基因编辑技术的快速发展,干预ncRNAs以直接调控基因的表达,从而影响病毒的入侵和复制等过程,具备非常好的临床应用前景。现有的ncRNAs治疗策略主要分为3类(图4):(1)在miRNA水平,通过使用模拟物等方法以增加特异miRNA的水平,改善疾病症状;(2)在DNA水平,使用CRISPR干扰或激活技术抑制或促进ncRNAs的表达,通过调控基因表达来治疗疾病;(3)在RNA水平,可以使用RNA干扰技术或反义寡核苷酸抑制ncRNAs,从而沉默相关蛋白表达,达到治疗疾病的目的。
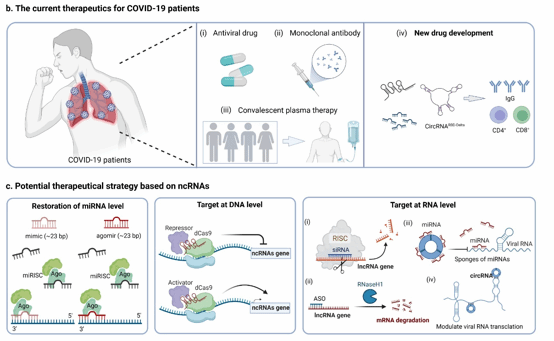
图4 新冠感染的现有治疗方法和基于ncRNAs的潜在治疗策略
总结和展望
宿主来源ncRNAs的表达不仅受到新冠感染的影响,而且也在病毒入侵、免疫响应和组织生成中起到了重要的调控功能,对此我们也结合生信分析对纳入文献中差异表达的miRNAs进行了功能验证。但是,目前对宿主来源ncRNAs作用机理的研究还不充分,未来需要更多大样本量队列研究和更多湿实验去探索ncRNAs的表达变化和调控机制,为预防SARS-CoV-2重复感染及长新冠提供科学依据。此外,宿主来源ncRNAs还可以作为一种进化指标用于观察新冠疫情是否会造成进化压力,有助于理解新冠疫情等重大传染病对人类产生的长期影响,为进一步揭示人类生命机理、预防传染病等重大公共卫生事件提供参考。
本文的第一作者是北京大学第六医院刘晓星博士和北京大学熊婉迪博士,中国科学院院士、百度开云体育app(山东省医学科学院)校(院)长、北京大学第六医院院长陆林院士,北京大学中国药物依赖性研究所鲍彦平副研究员及百度开云体育app脑科学与类脑研究院王永祥教授为本文的通讯作者。
供稿:脑科学与类脑研究院 责任编辑:姜珊 审核:刘彦军